Het Aufbau-principe is de basismethode die ons vertelt hoe de elektronen in de atomaire orbitaal worden gevuld. Volgens het Aufbau-principe volgt de vulling van de elektronen in de grondtoestand van een atoom een basispatroon. Dit principe vertelt ons dat de elektronen in de atomaire orbitaal van alle atomen gevuld zijn in de oplopende volgorde van hun energie en dat ze voor het vinden van de energie van de atomaire orbitaal de n+l-regel volgen.
Structuurprincipe
In dit artikel zullen we in detail leren over het Aufbau-principe, de kenmerken van het Aufbau-principe, de uitzonderingen en beperkingen ervan.
Structuur Principe Definitie
Het principe van Aufbau stelt dat
Elektronen in verschillende orbitalen worden gevuld in oplopende volgorde van hun energie, dat wil zeggen dat de orbitaal met de laagste energie als eerste wordt gevuld en de orbitaal met de hoogste energie als laatste.
Het woord ‘Aufbau’ betekent in het Duits ‘opbouwen’. Vorming van orbitalen betekent het vullen van orbitalen met elektronen. Er wordt gesteld dat de elektronen in atomaire orbitalen worden gevuld in de oplopende volgorde van de energie van de atomaire orbitaal. En de energie van de atomaire orbitaal wordt berekend met behulp van de n+l-regel die stelt of het elektron met een hoger getal van de n+l-waarde de hogere energie heeft. In de regel die in de vorige regel werd besproken, N vertelt het Principal Quantum-nummer en l vertelt het azimutale kwantumgetal.
Als twee elektronen dezelfde waarde van n+l hebben, dan is het elektron met een kleinere waarde van N heeft de kleinere energie en wordt als eerste gevuld. De volgorde van het vullen van de elektronen in een atomaire orbitaal wordt hieronder besproken.
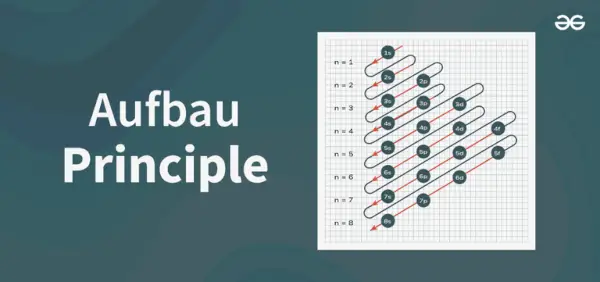
Structuur van het principediagram
Het Aufbau-principediagram is het diagram dat de volgorde weergeeft van het vullen van de elektronen in een atoom.
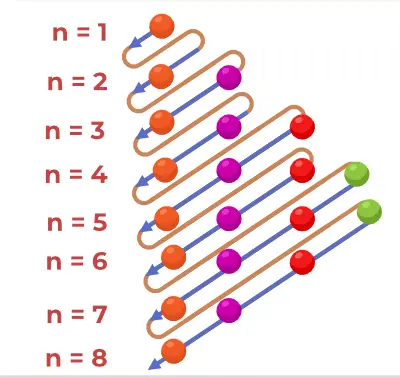
Structuur van het principediagram
Structuur van de principeformule
De Aufbau-principeformule is de formule die de volgorde aangeeft waarin de elektronen in de atomaire orbitaal worden gevuld. De atomaire orbitale formule is
1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p…….
Structuur van principeklasse 11
Het Aufbau-principe is een belangrijk principe van de scheikunde voor de leerlingen in klas 11. Dit principe stelt dat:
De elektronen in de atomaire orbitaal van een atoom worden gevuld in de oplopende volgorde van de energie van de atomaire orbitaal die wordt berekend met behulp van de (n+l) regel.
Het structuurdiagram tekenen
Het Aufbau-diagram wordt getekend met behulp van de onderstaande stappen,
- Zoek het aantal elektronen dat in de atomen moet worden ingevuld.
- We weten dat in een atoom de
- s-orbitaal kan maximaal 2 elektronen bevatten.
- p-orbitaal kan maximaal 6 elektronen bevatten.
- d-orbitaal kan maximaal 10 elektronen bevatten.
- f-orbitaal kan maximaal 14 elektronen bevatten.
- Vul de eerste twee elektronen in de 1s-orbitaal in.
- Volg dan de n+l-regel en vul vervolgens de elektronen dienovereenkomstig.
Opvallende kenmerken van het structuurprincipe
Verschillende kenmerken van het Aufbau-principe zijn:
- De energie van een orbitaal hangt af van de som van de waarden van het hoofdkwantumgetal (n) en het azimutale somgetal (I). Dit heet de (n + l) regel . Volgens deze regel
- In een neutraal geïsoleerd atoom geldt: hoe lager de waarde van (n + l) voor een orbitaal, hoe lager de energie ervan. Als twee verschillende soorten orbitalen echter dezelfde waarde hebben (n + l), dan hebben de orbitalen met een lagere waarde van n minder energie.
| Type orbitaal | Waarde van n | Waarde van l | Waarde van n+l | Relatieve energie |
|---|---|---|---|---|
| 1s | 1 | 0 | 1+0 = 1 | Laagste energie |
| 2s wat is bijenkorf | 2 | 0 | 2+0 = 2 | Hogere energie dan 1s orbitaal |
| 2p 3s | 2 3 | 1 wat is object-java 0 | 2+1=3 3+0 = 3 | 2p-orbitalen (n=2) hebben een lagere energie dan 3s(n=3)-orbitalen. |
| 3p 4s | 3 4 | 1 0 | 3+1=4 4+0 = 4 | 3p-orbitalen (n=3) hebben een lagere energie dan 4s(n=4)-orbitalen. |
| 3d 4p | 3 4 | 2 1 | 3+2=5 4+1=5 | 3d-orbitalen (n=3) hebben een lagere energie dan 4p(n=4)-orbitalen. |
Uit de beschrijving in de tabel volgt dat de energieën van de verschillende orbitalen toenemen met de toename van het getal van het hoofdkwantumgetal.
- Dus de volgorde waarin de elektronen worden gevuld in de atomaire orbitaal van de atoom is, 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p...
Elektronische configuratie met behulp van het Aufbau-principe
De elektronische configuratie Het gebruik van het Aufbau-principe voor een paar elementen wordt hieronder besproken:
Elektronenconfiguratie van zwavel
Atoomnummer van Zwavel is 16, d.w.z. het heeft 16 elektronen
Met behulp van het Aufbau-principe wordt de elektronische configuratie van de zwavel geschreven als:
[S] = 1s 2 2s 2 2p 6 3s 2 3p 4
Elektronenconfiguratie van stikstof
Het atoomnummer van stikstof is 7, dat wil zeggen dat het 7 elektronen heeft
Nu we het Aufbau-principe gebruiken, wordt de elektronische configuratie van de stikstof geschreven als:
[N] = 1s 2 2s 2 2p 3
Uitzonderingen op het constructieprincipe
Er zijn een paar uitzonderingen op het Aufbau-principe: chroom en koper. Hun elektronische configuratie is,
es5 versus es6
Elektronische configuratie van chroom
De elektronische configuratie van Chromium zou volgens het Aufbau-principe moeten zijn
- Cr(24): [Ar]3d 4 4s 2
Maar de bovenstaande configuratie is niet correct omdat de feitelijke elektronische configuratie van Chroom (Cr) is:
- Cr(24): [Ar]3d 5 4s 1
De reden voor deze elektronische configuratie is dat de halfgevulde d-atomaire orbitaal is stabieler dan de orbitaal gevuld volgens het Aufbau-principe.
Elektronische configuratie van koper
De elektronische configuratie van koper volgens het Aufbau-principe zou moeten zijn:
- Cu(29): [Ar]3d 9 4s 2
De bovenstaande configuratie is niet correct omdat de feitelijke elektronische configuratie van Koper (Cu) is:
- Cu(29): [Ar]3d 10 4s 1
De reden voor deze elektronische configuratie is dat de volledig gevulde d-atomaire orbitaal is stabieler dan de orbitaal gevuld volgens het Aufbau-principe.
Lees verder
- Kwantumgetallen
- Vorm van atomaire orbitalen
- Atoom structuur
Structuurprincipe – Veelgestelde vragen
Wat is het Aufbau-principe in de chemie?
Het Aufbau-principe in de scheikunde is het basisprincipe dat wordt gebruikt om de elektronen in de atomaire orbitalen van elk atoom te vullen. Deze stelling vertelt ons de volgorde waarin de elektronen in de atomaire orbitaal worden gevuld.
Wie heeft het Aufbau-principe gegeven?
Het Aufbau-principe werd in 1920 gegeven door de beroemde Deense natuurkundige Niels Bohr.
Wat is het uitsluitingsprincipe van Pauli?
Het uitsluitingsprincipe van Pauli stelt dat in een atoom geen twee elektronen alle vier kwantumgetallen hebben T hij hetzelfde. Tenminste, één van de kwantumgetallen is verschillend voor alle elektronen in het atoom.
Wat is de n+l-regel?
De n+l-regel is de regel die stelt dat de energie van een orbitaal afhangt van de som van het hoofdkwantumgetal (n) en het azimutale kwantumgetal (l). deze regel wordt de (n+l)-regel genoemd.
Wat zijn de uitzonderingen op het Aufbau-principe?
De uitzondering op het Aufbau-principe is:
- Elektronische configuratie van chroom-Cr[24]
- Elektronische configuratie van koper-Cu[29]
