Atomaire orbitalen , dit zijn wiskundige functies, die het golfgedrag van elektronen (of elektronenparen) in een atoom beschrijven. Atoomorbitalen hebben verschillende vormen, afhankelijk van hun type. De verschillende vormen van atomaire orbitalen beschrijven dat er in sommige richtingen de hoogste of nul waarschijnlijkheid is om een elektron rond de kern aan te treffen. Er zijn vier soorten orbitalen, elk met een andere vorm en weergegeven door de letters s, p, d en f. Er wordt rekening gehouden met de s- en p-orbitalen omdat deze het meest voorkomen in de chemische en biologische chemie. Een s-orbitaal heeft een bolvormige kern in het midden, a p-orbitaal is haltervormig, en vier van de vijf d orbitalen zijn klaverbladvormig. De vijfde d-orbitaal heeft de vorm van een lange halter met een donut in het midden. De orbitalen van een atoom zijn georganiseerd in lagen of elektronenschillen.
Wat zijn atomaire orbitalen?
Atoomorbitalen zijn de driedimensionale ruimte nabij de kern van een atoom waar de mogelijkheid om een elektron te ontdekken maximaal is.
Een atoom kan volgens het kwantumatomaire model een oneindig aantal orbitalen hebben. Deze orbitalen kunnen worden geclassificeerd op basis van hun grootte, vorm of oriëntatie. Een smallere orbitaal betekent dat er een grotere kans is om een elektron dicht bij de kern te vangen. De orbitale golffunctie staat vaak bekend als een wiskundige functie die wordt gebruikt om de coördinaten van een elektron uit te drukken. De waarschijnlijkheid dat een elektron wordt gelokaliseerd, wordt weergegeven door het kwadraat van de orbitale golffunctie. Deze golffunctie helpt ook bij het maken van grensoppervlakdiagrammen.
Orbitale golffunctie
De kwantumatomair model voorspelt dat een atoom een grote verscheidenheid aan orbitalen kan hebben. Deze orbitalen kunnen worden gegroepeerd op basis van hun grootte, geometrie of helling. Een kleinere orbitale grootte vergroot de kans op het verkrijgen van een elektron dicht bij de kern. De wiskundige functie die wordt gebruikt om de coördinaten van een elektron weer te geven, wordt de genoemd orbitale golffunctie . De waarschijnlijkheid om een elektron te ontdekken wordt weergegeven door het kwadraat van de orbitale golffunctie.
We kunnen deze golffunctie ook gebruiken om grensoppervlakdiagrammen te maken. We kunnen de vorm van orbitalen beter begrijpen door grensoppervlakdiagrammen te gebruiken van de constante waarschijnlijkheidsdichtheid voor verschillende orbitalen.
hoeveel steden zijn er in de verenigde staten
Vormen van atomaire orbitalen
De vormen van de atomaire orbitalen variëren. Dat wil zeggen dat de waarschijnlijkheidsverdelingen van de elektronen die ze beschrijven rond de kern verschillend zijn. Het feit dat de elektronen in verschillende orbitalen zich waarschijnlijk in verschillende gebieden rond de moederkern bevinden en daardoor de aantrekkingskracht van laatstgenoemde met verschillende sterktes ervaren, is een van de redenen waarom orbitalen qua energie variëren. Het is verbazingwekkend dat alle orbitalen in een bepaalde schil van het waterstofatoom dezelfde energie hebben, terwijl ze verschillende vormen hebben. Dit komt door de eliminatie van verschillende energiegerelateerde bijdragen.
Maar zodra er een tweede elektron is, verdwijnt de degeneratie.
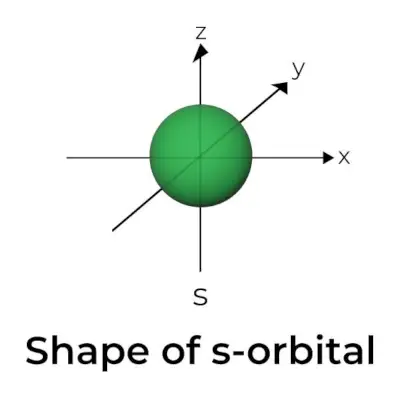
Vorm van s-orbitaal
- Het s orbitale grensoppervlakdiagram lijkt op een bol met de kern in het midden, die in twee dimensies als een cirkel kan worden weergegeven.
- s-orbitalen zijn sferisch symmetrisch, wat betekent dat de kans om een elektron op een bepaalde afstand te vinden in alle richtingen hetzelfde is.
- Er wordt eveneens aangetoond dat de grootte van de s-orbitaal toeneemt naarmate de waarde van het primaire kwantumgetal (n) toeneemt; dus 4s> 3s> 2s> 1s.
- Het knooppunt is een locatie waar er geen kans is om het elektron te lokaliseren. Knooppunten worden ingedeeld in twee typen: radiale knooppunten en hoekige knooppunten. De afstand tot de kern wordt berekend door de radiale knooppunten, terwijl de oriëntatie wordt bepaald door de hoekige knooppunten.
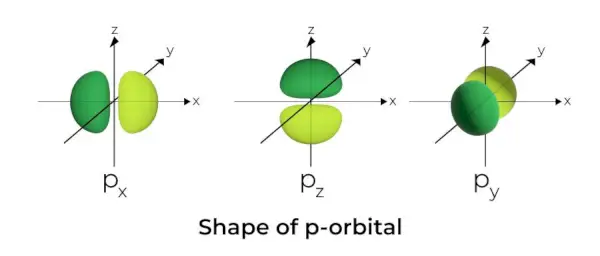
Vorm van p-orbitaal
- De p-orbitalen zijn gevormd als halters.
- Het p-orbitale knooppunt bevindt zich in het midden van de kern.
- Door de aanwezigheid van drie orbitalen kan de p-orbitaal maximaal zes elektronen bezetten.
- Elke p-orbitaal bestaat uit twee delen die bekend staan als lobben en die zich aan weerszijden van het vlak bevinden dat door de kern loopt.
- Elke p-orbitaal heeft delen die bekend staan als lobben aan weerszijden van het vlak dat door de kern loopt. Op het vlak waar de twee lobben elkaar kruisen, is de kans op het vinden van een elektron nul.
- De drie orbitalen staan bekend als gedegenereerde orbitalen omdat ze dezelfde grootte, vorm en energie hebben.
- Het enige verschil tussen de orbitalen is de oriëntatie van de lobben. Omdat de lobben langs de x-, y- of z-as zijn georiënteerd, krijgen ze de naam 2px, 2py, en 2pz. De formule n –2 wordt gebruikt om het aantal knooppunten te berekenen.
- Net als bij s-orbitalen nemen de grootte en energie van p-orbitalen toe naarmate het primaire kwantumgetal toeneemt (4p> 3p> 2p).
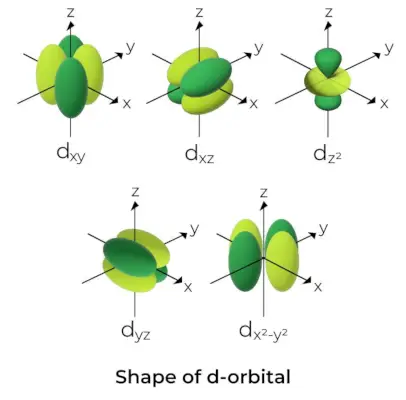
Vorm van d-orbitaal
- Voor d-orbitalen wordt het magnetische orbitale kwantumgetal gegeven als (-2,-1,0, 1,2). Als gevolg hiervan kunnen we beweren dat er vijf d-orbitalen zijn.
- Deze orbitalen worden aangegeven met de symbolen dxy, Dyz, Dxz, DX2-En2, en dMet2.
- De vormen van de eerste vier d-orbitalen lijken op elkaar, wat verschilt van de dMet2orbitaal, maar de energie van alle vijf d-orbitalen is hetzelfde.
Vorm van f-orbitaal
- De vorm van de f-orbitaal is verspreid. Omdat de waarde van l=3 voor de f-orbitaal, is de minimale waarde van het primaire kwantumgetal n 4.
- De equivalente ml-waarden voor de f-orbitaal zijn (-3,–2, –1, 0, +1, +2, +3).
- Als resultaat zijn er zeven f-orbitalen voor l = 3.

Java-teken naar int
Gedegenereerde orbitalen
Gedegenereerde orbitalen zijn orbitalen met dezelfde energie. Deze orbitalen zijn verschillend (ze kunnen anders georiënteerd zijn in de ruimte rond de atoomkern ), maar toch hebben ze dezelfde energie. In de aanwezigheid van een extern veld wordt de degeneratie van de p-orbitaal niet beïnvloed; de degeneratie van de f- en d-orbitalen kan echter worden doorbroken door een extern veld op het systeem aan te leggen (elektrisch of magnetisch veld).
Er zijn maar weinig orbitalen die een hogere energie zullen hebben, terwijl andere een lagere energie zullen hebben. Er zal geen degeneratie meer bestaan in het systeem. D-orbitalen bestaan bijvoorbeeld uit vijf gedegenereerde orbitalen die allemaal dezelfde energie hebben.
Lees verder:
- Moleculaire orbitaaltheorie
- Vullen van orbitaal in een atoom
- Hybridisatie
Veelgestelde vragen over vormen van atomaire orbitalen
Vraag 1: Hoe werken orbitalen?
typoscript foreach lus
Antwoord:
Een atomaire orbitaal is een wiskundige uitdrukking die het golfachtige gedrag van één elektron of een paar elektronen in een atoom uitdrukt in de atoomtheorie en de kwantummechanica. Elke orbitaal neemt maximaal twee elektronen op, elk met zijn eigen hoeveelheid spin.
Vraag 2: Wat is een knooppuntvlak?
Antwoord:
Het vlak waar de kans op het vinden van een elektron verwaarloosbaar of nul is, wordt het knooppuntvlak genoemd.
Diana Maria Zwarter
Vraag 3: Hoeveel orbitalen zijn er?
Antwoord:
Omdat het s-subniveau slechts één orbitaal heeft, kunnen er slechts twee elektronen aanwezig zijn. Omdat het p-subniveau drie orbitalen omvat, kunnen er maximaal zes elektronen aanwezig zijn. Omdat het d-subniveau uit 5 orbitalen bestaat, kunnen er maximaal 10 elektronen aanwezig zijn. En elk van de vier subniveaus heeft zeven orbitalen die maximaal veertien elektronen kunnen bevatten.
Vraag 4: Welke orbitalen hebben de hoogste energie?
Antwoord:
webbrowserinstellingen
De orbitaal 1s heeft de meeste energie. De energie van een elektron is de hoeveelheid energie die nodig is om het uit de elektrische bel van het atoom te halen.
Vraag 5: Wat is het verschil tussen een schaal en een orbitaal?
Antwoord:
In een atoom is een schil een verzameling subschillen van dezelfde kwantumgetaltheorie, n. Orbitalen hebben elk twee elektronen, en elektronen in dezelfde orbitaal hebben dezelfde definitie van grootte, impulsmomentgrootte en magnetisch kwantumgetal.
Vraag 6: Wat is de sigma- en pi-binding?
Antwoord:
Atomaire orbitale overlap creëert sigma- en pi-bindingen. Sigma-bindingen worden gecreëerd door overlappende atomaire orbitale lobben, terwijl Pi-bindingen worden gegenereerd wanneer de ene atomaire orbitale lob de andere overlapt.
