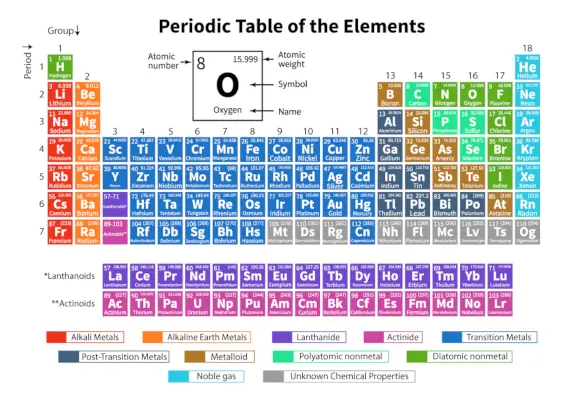
De Periodiek systeem van elementen is een systematische rangschikking van 118 bekende chemische elementen. Deze chemische elementen zijn georganiseerd in volgorde van toenemend atoomnummer. De horizontale rijen van links naar rechts worden perioden genoemd, terwijl de verticale kolommen van boven naar beneden groepen worden genoemd in een periodiek systeem.
Inhoudsopgave
- Wat is periodiek systeem?
- Lijst met periodieke tabelelementen
- Belangrijke termen in het periodiek systeem
- Classificatie van elementen in het periodiek systeem
- Periodiek systeem van Mendelejev
- Veelgestelde vragen over periodiek systeem der elementen
Wat is periodiek systeem?
Een periodiek systeem is een weergave in tabelvorm waarin alle bekende chemische elementen zijn gerangschikt in horizontale rijen, perioden genoemd, en verticale kolommen, groepen genoemd, op basis van hun atoomnummer en atomaire structuur respectievelijk.
Het is een rangschikking van alle bekende elementen en biedt daarom informatie over de elementen, zoals hun massa, elektronenaantal, elektronenconfiguratie en hun unieke chemische eigenschappen.
Lijst met periodieke tabelelementen
Hier is de tabel die 118 elementen van het periodiek systeem vertegenwoordigt. De genoemde elementen zijn gerangschikt volgens de oplopende volgorde van het atoomnummer en hun respectieve atoomgewicht, symbool, dichtheid en elektronegativiteit.
| Elementen in periodiek systeem met atoommassa | |||||
|---|---|---|---|---|---|
| Atoomnummer | Naam van chemisch element | Symbool | Atoommassa (amu) | Dichtheid (g/cm 3 ) | Elektronegativiteit |
| 1 | Waterstof | H | 1,0079 | 0,00008988 | 2.2 |
| 2 | Helium | Hij | 4,0026 | 0,0001785 | – |
| 3 | Lithium | Dat | 6.941 | 0,534 | 0,98 |
| 4 | Beryllium | Zijn | 9,0122 | 1,85 | 1,57 |
| 5 | Borium | B | 10.811 | 2.34 | 2.04 |
| 6 | Koolstof | C | 12.0107 | 2.267 | 2,55 |
| 7 | Stikstof | N | 14.0067 | 0,0012506 | 3.04 |
| 8 | Zuurstof | O | 15,9994 | 0,001429 | 3.44 |
| 9 | Fluor | F | 18,9984 | 0,001696 | 3,98 |
| 10 | Neon | Ja | 20.1797 | 0,0009002 | – |
| elf | Natrium | Al | 22,9897 | 0,968 | 0,93 |
| 12 | Magnesium | mgr | 24.305 | 1.738 | 1.31 |
| 13 | Aluminium | Naar de | 26,9815 | 2.7 | 1,61 |
| 14 | Silicium | Ja | 28.0855 | 2.329 | 1.9 |
| vijftien | Fosfor | P | 30,9738 | 1.823 | 2.19 |
| 16 | Zwavel | S | 32.065 | 2.07 | 2.58 |
| 17 | Chloor | Kl | 35.453 | 0,0032 | 3.16 |
| 18 | Argon | Met | 39.948 | 0,001784 | – |
| 19 | Potassium | K | 39,0983 | 0,89 | 0,82 |
| twintig | Calcium | Dat | 40.078 | 1,55 | 1 |
| eenentwintig | Scandium | sc | 44,9559 | 2.985 | 1.36 |
| 22 | Titanium | Van | 47.867 | 4.506 | 1,54 |
| 23 | Vanadium | IN | 50,9415 | 6.11 | 1,63 |
| 24 | Chroom | Cr | 51,9961 | 7.15 | 1,66 |
| 25 | Mangaan | Mn | 54.938 | 7.21 | 1,55 |
| 26 | Ijzer | Vertrouwen | 55.845 | 7.874 | 1,83 |
| 27 | Kobalt | Co | 58,9332 | 8.9 | 1,88 |
| 28 | Nikkel | In | 58,6934 | 8.908 | 1,91 |
| 29 | Koper | Met | 63.546 | 1.9 | 60 |
| 30 | Zink | Zn | 65.39 | 1,65 | 70 |
| 31 | Gallium | Hier | 69.723 | 1,81 | 19 |
| 32 | Germanium | Ge | 72,64 | 2.01 | 1.5 |
| 33 | Arseen | Als | 74,9216 | 2.18 | 1.8 |
| 3. 4 | Selenium | HIJ | 78,96 | 2,55 | 0,05 |
| 35 | Broom | Br | 79.904 | 2,96 | 2.4 |
| 36 | Krypton | NOK | 83.798 | 3 | 1×10−4 |
| 37 | Rubidium | Rb | 85,4678 | 0,82 | 90 |
| 38 | Strontium | sr | 87,62 | 0,95 | 370 |
| 39 | Yttrium | EN | 88.906 | 1.22 | 33 |
| 40 | Zirkonium | Zr | 91.224 | 1.33 | 165 |
| 41 | Niobium | Nb | 92.906 | 1.6 | twintig |
| 42 | Molybdeen | ma | 95,94 | 2.16 | 1.2 |
| 43 | Technetium | Tc | 98 | 1.9 | ~ 3×10−9 |
| 44 | Ruthenium | Ru | 101.07 | 2.2 | 0,001 |
| Vier vijf | Rhodium | Rh | 102,91 | 2.28 | 0,001 |
| 46 | Palladium | Pd | 106.42 | 2.2 | 0,015 |
| 47 | Zilver | Bij | 107,87 | 1,93 | 0,075 |
| 48 | Cadmium | CD | 112.411 | 1,69 | 0,159 |
| 49 | Indium | In | 114,82 | 1,78 | 0,25 |
| vijftig | Geloven | sn | 118,71 | 1,96 | 23 |
| 51 | Antimoon | Zb | 121,76 | 2.05 | 0,2 |
| 52 | Tellurium | De | 127,6 | 2.1 | 0,001 |
| 53 | Jodium | I | 126,9045 | 2,66 | 0,45 |
| 54 | Xenon | Auto | 131.293 | 2.6 | 3×10−5 |
| 55 | Cesium | Cs | 132,91 | 0,79 | 3 |
| 56 | Barium | Niet | 137.327 | 0,89 | 425 |
| 57 | Lanthaan | De | 138,91 | 1.1 | 39 |
| 58 | Cerium | Dit | 140.12 | 1.12 | 66,5 |
| 59 | Praseodymium | Pr | 140,9077 | 1.13 | 9.2 |
| 60 | Neodymium | Nd | 144,24 | 1.14 | 41,5 |
| 61 | Promethium | P.m | 145 | 1.13 | 2 × 10−19 |
| 62 | Samarium | sm | 150,36 | 1.17 | 7.05 |
| 63 | Europium | EU | 151.964 | 1.2 | 2 |
| 64 | Gadolinium | Gd | 157,25 | 1.2 | 6.2 |
| 65 | Terbium | Tb | 158,9253 | 1.2 | 1.2 |
| 66 | Dysprosium | Die | 162,5 | 1.22 | 5.2 |
| 67 | Holmium | Naar | 164,9303 | 1.23 | 1.3 |
| 68 | Erbium | Is | 167.259 | 1.24 | 3.5 |
| 69 | Thulium | Tm | 168,9342 | 1.25 | 0,52 |
| 70 | Ytterbium | Ja | 173.04 | 1.1 | 3.2 |
| 71 | Parijs | Lu | 174.967 | 1.27 | 0,8 |
| 72 | Hafnium | Hf | 178,49 | 1.3 | 3 |
| 73 | Tantaal | Geconfronteerd | 180,9479 | 1.5 | 2 |
| 74 | Wolfraam | IN | 183,84 | 2.36 | 1.3 |
| 75 | Rhenium | Met betrekking tot | 186.207 | 1.9 | 7×10−4 |
| 76 | Osmium | Jij | 190,23 | 2.2 | 0,002 |
| 77 | Iridium | En | 192.22 | 2.2 | 0,001 |
| 78 | Platina | Pt | 195.08 | 2.28 | 0,005 |
| 79 | Goud | Bij | 196,97 | 2.54 | 0,004 |
| 80 | Kwik | Hg | 200,59 | 2 | 0,085 |
| 81 | Thallium | Tl | 204.3833 | 1,62 | 0,85 |
| 82 | Leiding | Pb | 207,2 | 1,87 (2+) 2,33 (4+) | 14 |
| 83 | Bismut | Met een | 208,9804 | 2.02 | 0,009 |
| 84 | Polonium | Na | 209 | 2 | 2×10−10 |
| 85 | Astatijn | Bij | 210 | 2.2 | 3×10−20 |
| 86 | Radon | Rn | 222 | 2.2 | 4 × 10−13 |
| 87 | Francium | Fr | 223 | >0,79[6] | ~ 1×10−18 |
| 88 | Radium | Zon | 226 | 0,9 | 9×10−7 |
| 89 | Actinium | En | 227 | 1.1 | 5,5 × 10−10 |
| 90 | Thorium | E | 232.0381 | 1.3 | 9.6 |
| 91 | Protactinium | Goed | 231.0359 | 1.5 | 1,4 × 10−6 |
| 92 | Uranium | IN | 238.0289 | 1,38 | 2.7 |
| 93 | Neptunus | Bijvoorbeeld | 237 | 1.36 | ≤ 3×10−12 |
| 94 | Plutonium | Zou kunnen | 244 | 1.28 | ≤ 3×10−11 |
| 95 | Amerika | Ben | 243 | 1.13 | – |
| 96 | Curium | Cm | 247 | 1.28 | – |
| 97 | Berkelium | Bk | 247 | 1.3 | – |
| 98 | Californië | Zie | 251 | 1.3 | – |
| 99 | Einsteinium | Is | 252 | 1.3 | – |
| 100 | Fermium | FM | 257 | 1.3 | – |
| 101 | Mendelejev | Md | 258 | 1.3 | – |
| 102 | Edele | Nee | 259 | 1.3 | – |
| 103 | Lawrencenium | Lr | 262 | 1.3 | – |
| 104 | Rutherfordium | Rv | 267 | – | – |
| 105 | Dubnium | DB | 268 | – | – |
| 106 | Seaborgium | Sg | 269 | – | – |
| 107 | Bohrium | Bh | 270 | – | – |
| 108 | Hassium | Hs | 269 | – | – |
| 109 | Meitnerium | Mt | 277 | – | – |
| 110 | Darmstadtium | Ds | 281 | – | – |
| 111 | Röntgenium | Rg | 282 | – | – |
| 112 | Copernicus | Cn | 285 | – | – |
| 113 | Nihonium | Nh | 286 | – | – |
| 114 | Flerovium | In | 290 | – | – |
| 115 | Moscovium | Mc | 290 | – | – |
| 116 | Livermorium | Lv | 293 | – | – |
| 117 | Tennessine | Ts | 294 | – | – |
| 118 | Oganesson | En | 294 | – | – |
Belangrijke termen in het periodiek systeem
| Voorwaarden kat timpf gewicht | Beschrijving |
|---|---|
| Atoomnummer | Het aantal protonen dat de kern van een element vormt, wordt het atoomnummer (Z) genoemd. bijv. Koolstof bevat dan 6 protonen, dus het atoomnummer mag slechts 6 zijn. |
| Atoom massa | Het wordt gedefinieerd als de gemiddelde massa van de atomen van een element. Het wordt gemeten op basis van de relatieve natuurlijke overvloed van de isotopen van het element. Atoom massa wordt ook wel atoomgewicht (A) genoemd. Het wordt gemeten in de atomaire massa-eenheid (amu). |
| Periode | De horizontale rijen van links naar rechts in een periodiek systeem worden perioden genoemd. Er zijn in totaal 7 perioden in het periodiek systeem. De elementen zijn horizontaal gerangschikt vanwege hun overeenkomsten in eigenschappen, zoals dezelfde atomaire orbitalen enzovoort. |
| Groep | De verticale kolommen van boven naar beneden in een periodiek systeem worden groepen genoemd. Er zijn in totaal 18 groepen in het periodiek systeem. De elementen zijn verticaal gerangschikt vanwege hun overeenkomsten in eigenschappen, omdat ze hetzelfde aantal valentie-elektronen bevatten. |
| Symbool van een element | Een symbool is een begrip dat wordt gebruikt om een chemisch element weer te geven met behulp van een letter of een combinatie van twee tot drie letters. bijv. Het chemische symbool van koolstof is C, terwijl Fe wordt gebruikt voor ijzer enzovoort. |
Classificatie van elementen in het periodiek systeem
De 118 elementen zijn gerangschikt in 7 perioden en 18 groepen, zoals hierboven weergegeven. Verder zijn de elementen verdeeld in verschillende blokken.
| Blok | Elementen inbegrepen | Laatste elektronensubshell gevuld |
|---|---|---|
| s-blok | Groep 1 (Alkalimetalen) | s-subshell |
| Groep 2 (aardalkalimetalen) | ||
| p-blok | Groep 13 (Boron-familie) | p-subshell |
| Groep 14 (Carbon-familie) | ||
| Groep 15 (Stikstoffamilie) | ||
| Groep 16 (Zuurstoffamilie) | ||
| Groep 17 (Fluorfamilie) | ||
| d-blok | Groepen 3 t/m 12 (Overgangselementen) | d-subshell |
| f-blok | Lanthaniden (zeldzame aardelementen) | f-subshell |
| Actiniden |
Periodiek systeem van Mendelejev
Om overeenkomsten en trends in het gedrag van elementen weer te geven, ontwikkelde Mendelejev het periodiek systeem, een rangschikking van elementen in toenemende atomaire massavolgorde in tabelvorm.

Volgens het periodiek systeem van Mendelejev waren de elementen gerangschikt op basis van hun fundamentele eigenschap, atoommassa en chemische kenmerken. Ten tijde van het werk van Mendelejev waren slechts 63 elementen bekend. In het periodiek systeem van Mendelejev werden de horizontale rij en verticale kolommen respectievelijk groepen en perioden genoemd.
Het periodiek systeem van Mendelejev faalt echter vanwege de vele tekortkomingen ervan. Sommigen van hen zijn dat het er niet in is geslaagd waterstof en edelgassen aan te duiden. Ook was de toenemende volgorde van de atomaire massa van de elementen niet regelmatig in de hele tabel. Zelfs de ontdekking van isotopen is in strijd met de Periodieke Wet van Mendelejev.
Lees verder:
- Moderne Periodiek Systeem
- Periodiek systeem van Mendelejev
- Modern periodiek recht
- Geschiedenis van het periodiek systeem
- Atoom structuur
Veelgestelde vragen over periodiek systeem der elementen
Wat is periodiek systeem der elementen?
Het Periodiek Systeem der Elementen is een tabellarische rangschikking van chemische elementen, georganiseerd op basis van hun atoomnummer, elektronenconfiguratie en terugkerende chemische eigenschappen. De tabel is verdeeld in rijen die perioden worden genoemd en kolommen die groepen of families worden genoemd.
Wie heeft het periodiek systeem der elementen ontdekt?
Het periodiek systeem der elementen is niet door één persoon ontdekt, maar de ontwikkeling ervan wordt toegeschreven aan Dmitri Mendelejev, een Russische scheikundige, die in 1869 de elementen rangschikte op basis van hun eigenschappen.
Wie heeft het moderne periodiek systeem gemaakt?
In 1913 introduceerde Henry Moseley een bijgewerkte versie van het periodiek systeem, gewoonlijk het moderne periodiek systeem genoemd.
Hoe is het periodiek systeem gerangschikt?
Het periodiek systeem is gerangschikt in volgorde van oplopend atoomnummer, waarbij de elementen zijn gegroepeerd op basis van vergelijkbare chemische eigenschappen en zijn gerangschikt in perioden (rijen) en groepen (kolommen).
Wat is atoomnummer?
Het aantal protonen dat de kern van een element vormt, wordt het atoomnummer (Z) genoemd. bijv. Koolstof bevat dan 6 protonen, het atoomnummer mag slechts 6 zijn.
Kunnen twee verschillende elementen hetzelfde atoomnummer hebben?
Het aantal neutronen in een atoom uit twee verschillende elementen kan vergelijkbaar zijn, maar het aantal protonen zal nooit hetzelfde zijn. Elk element heeft een specifiek aantal protonen, wat overeenkomt met het aantal atomen.
Hoe de atomaire massa berekenen?
De atoommassa kan worden berekend door de massa van protonen en neutronen in een element bij elkaar op te tellen.
Wat is een groep in het periodiek systeem?
De kolom in het periodiek systeem verwijst naar de groep van het periodiek systeem. De elementen van dezelfde groep hebben vergelijkbare fysische en chemische eigenschappen.
