Base is een chemische verbinding die bestaat uit OH–ionen en accepteert protonen. Basis in de scheikunde zijn die verbindingen die rode lakmoes blauw kleuren en wanneer ze met zuur reageren, neutraliseren ze de reactie om zout en water te geven. De pH-waarde van de basis is groter dan 7. Basen zijn bitter van smaak en glad bij aanraking. De basen die oplosbaar zijn in water worden alkaliën genoemd. Voorbeelden van basen zijn metaaloxiden, metaalhydroxiden, enz. Zeep is een voorbeeld van een basis die we in het dagelijks leven gebruiken. In dit artikel zullen we in detail leren over de definitie, eigenschappen en chemische reacties van basen.

Basisdefinitie
Base wordt gedefinieerd als de chemische verbinding waarvan de pH-waarde groter is dan 7, een proton accepteert, zuur neutraliseert en rode lakmoes in blauw verandert. Ze bevrijden over het algemeen OH–ion op dissociatie. Voorbeelden omvatten NaOH, NaHCO3,enz. Hieronder volgen enkele algemene kenmerken van de basis:
- Ze hebben een bittere smaak
- Ze zijn glad in contact
- Ze worden rood lakmoesblauw
- Ze bevrijden OH–ion wanneer opgelost in water
- Ze geleiden elektriciteit in oplossingsvorm
Basen zijn een van de belangrijkste chemische verbindingen die in het dagelijks leven worden gebruikt. Basen worden gebruikt als antacidum om de zuurgraad onder controle te houden en in tandpasta om de bacteriële werking te neutraliseren die zuur in onze mond produceert en afbraak van glazuur en holtes voorkomt. Ze worden ook gebruikt als bakpoeder, zuiveringszout en waspoeder.
Lewis-basis
Lewis-basen zijn de verbindingen die een elektronenpaar hebben en ze kunnen dit doneren aan de verbindingen die een tekort aan elektronenparen hebben. Lewis-basen zijn nucleofiel van aard, dat wil zeggen dat ze kernminnend zijn, wat betekent dat ze een positief geladen centrum zullen aanvallen met hun elektronenparen. Voorbeelden van Lewis Base zijn ammoniak, omdat in ammoniak (NH3) het centrale atoom Stikstof heeft 5 elektronen waarvan er 3 worden gebruikt bij het maken van bindingen met 3 waterstofatomen en één paar elektronen blijft achter bij het N-atoom, waardoor NH ontstaat3een Lewis-basis.
Arrhenius-basis
Volgens het concept van Arrhenius zijn basen verbindingen die hydroxide-ionen vrijgeven wanneer ze in water worden opgelost en de concentratie van hydroxylionen in de waterige oplossing verhogen. Als KOH bijvoorbeeld in water wordt opgelost, ontstaat er OH–ion en verhoogt zo de concentratie van OH–in het water.
Bronsted-basis
Bronsted Concept of Base is een geavanceerde versie van het concept van Arrhenius, waarin staat dat basen verbindingen zijn die H accepteren+ion of proton om hun geconjugeerde zuur te vormen. Bijvoorbeeld Kl–is een basis die H accepteert+om HCl als zijn conjugaatzuur te vormen.
Soorten basen
Basen kunnen worden geclassificeerd op basis van zuurgraad, concentratie en ionisatievermogen. De classificatie wordt hieronder vermeld
Soorten basen op basis van zuurgraad
Zuurgraad van een base verwijst naar het aantal vervangbare hydroxylgroepen dat aanwezig is in één molecuul van de base. Op basis van de zuurgraad worden basen ingedeeld in drie categorieën:
- Monozure basis
- Diacidische basis
- Trizure basis
Monozuur: Monozure basen zijn basen die slechts één vervangbaar hydroxylion bevatten en een interactie aangaan met slechts één waterstofion. Monozure basen omvatten NaOH, KOH en andere.
Diacidisch: Dizuurbase is een base met twee vervangbare hydroxylionen die een interactie aangaan met twee waterstofionen. Ca(OH)2, Mg(OH)2en andere dizuurbasen zijn voorbeelden.
Trizuur: Trizure base is een type base dat drie vervangbare hydroxylionen en drie waterstofionen omvat. Trizure basen omvatten Al (OH)3, Fe(OH)3, en anderen.
Soorten basen op basis van hun concentratie in waterige oplossing
Concentratie verwijst naar de hoeveelheid base die aanwezig is in een waterige oplossing. Op basis van hun concentratie in waterige oplossing worden basen onderverdeeld in twee categorieën:
- Geconcentreerde basis
- Verdunde basis
Geconcentreerde basis: Geconcentreerde basen zijn die waarbij de hoeveelheid base groot is in vergelijking met het oplosmiddel. Geconcentreerde NaOH-oplossing bijvoorbeeld.
Verdunde basis: Dit soort basen hebben een lagere baseconcentratie in hun waterige oplossing. Verdunning is het proces waarbij het percentage opgeloste stof wordt verminderd door een grotere hoeveelheid oplosmiddel toe te voegen. Verdun bijvoorbeeld NaOH, verdun KOH, enzovoort.
willekeurig getal gen java
Soorten basen op basis van de mate van ionisatie
De mate van ionisatie verwijst naar het vermogen van een chemische verbinding om het samenstellende ion vrij te maken wanneer het in water wordt opgelost. In het geval van Base verwijst de mate van ionisatie naar het vermogen van de base om OH af te geven–ionen wanneer ze in water worden opgelost. Op basis van de mate van ionisatie worden basen in twee typen ingedeeld:
- Sterke basis
- Zwakke basis
Sterke basis: Sterke basen zijn basen die volledig dissociëren en OH-ionen vrijmaken wanneer ze in water worden opgelost. Enkele voorbeelden van sterke basen zijn NaOH, KOH, enz.
Zwakke basis: De basen die geen volledige dissociatie ondergaan en slechts een fractie van het OH-ion vrijmaken, worden zwakke basen genoemd. Voorbeelden van zwakke basen zijn Al (OH)3,Cu(OH)2,enz.
Kom meer te weten, Sterke en zwakke basen
Eigenschappen van basen
Zoals we weten zijn basen chemische verbindingen die OH-ionen hebben, rood lakmoesblauw worden, enz. In dit gedeelte zullen we leren over de fysische en chemische eigenschappen van basen, samen met enige korte kennis van hun algemene eigenschappen.
Algemene eigenschappen van basis
De algemene eigenschappen van Bases worden hieronder vermeld:
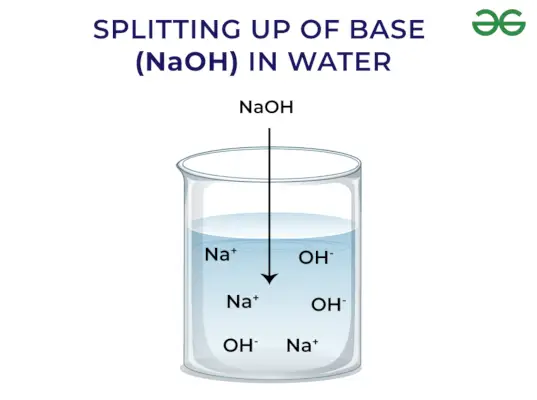
- Een hydroxide-ion (OH–) wordt door basen in het water afgegeven. Hoe sterker de basis wordt naarmate er meer ionen vrijkomen.
- Basen reageren met zuur en vormen zout. Zuren reageren met basen. Deze reactie van een base met zuur wordt een neutralisatiereactie genoemd.
- Basissen veranderen rode lakmoes in blauw.
- De structuur van een eiwit kan door basen worden veranderd. Bases hebben deze kwaliteit, waardoor ze glad aanvoelen. Zeep is een basis die ongelooflijk glad wordt op je huid als hij nat is. Vanwege hun vermogen om de structuur van eiwitten te wijzigen, zijn sommige krachtige basen uiterst gevaarlijk.
Fysische eigenschappen van basen
Basissmaak Bitter: Basen zijn bitter van smaak. Vanwege de bitterheid hebben we slechts een paar alkalische voedingsmiddelen. Er zijn slechts een paar alkalische voedingsmaterialen. Basen moeten met meer voorzichtigheid worden geproefd in vergelijking met zuren.
Basissen zijn glad bij aanraking: Bij aanraking voelen de honken glad aan. Bijvoorbeeld zeep.
Basen geven OH vrij – Ion: Wanneer basen in water worden opgelost, geven ze hydroxylionen (OH) vrij–). Afhankelijk van het vermogen om hydroxylionen vrij te maken, worden ze geclassificeerd als Sterk en Zwak.
formatteer de datum in Java
Basen neutraliseren zuren: Wanneer basen reageren met zuren, neutraliseren ze elkaar en produceren ze zout en water. Deze reactie wordt genoemd Neutralisatie-reactie . Laten we zeggen dat we het zuur HY en de base ‘XOH’ hebben, dan zal het gevormde zout ‘XY’ zijn. De vergelijking voor deze reactie kan worden gegeven als HY + XOH → HOH + XY.
Basen Denatureren Eiwit: Denaturatie van eiwitten betekent de vernietiging van de stabiliteit en structuur van het eiwit. Dit maakt het gebruik van base schadelijk voor de mens, aangezien de menselijke huid en het haar uit eiwitten bestaan en wanneer sterke alkaliën zoals natrium- of kaliumhydroxide, ook wel Lye genoemd, een schadelijke invloed op de menselijke huid hebben.
Basissen veranderen rode lakmoes in blauw: Wanneer basen in contact worden gebracht met rode lakmoes, kleuren ze deze blauw. Er moet echter worden opgemerkt dat een dergelijke verandering niet kan worden waargenomen wanneer we de droge basis proberen te laten reageren met rood lakmoespapier. De lakmoespapiertest is een van de oudste methoden om de basis te testen. Er bestaan echter ook andere indicatoren, zoals fenolftaleïne
Basen geleiden elektriciteit: Wanneer basen zich in oplossingsvorm bevinden, hebben ze mobiele OH-ionen en kunnen ze elektriciteit geleiden.
Chemische eigenschappen van basen
- Reactie van basis met metalen: Wanneer alkali (base) reageert met metaal, ontstaat er zout en waterstofgas.
Alkali + Metaal → Zout + Waterstof
Voorbeelden:
- Wanneer natriumhydroxide interageert met aluminiummetaal, worden natriumaluminaat en waterstofgas gegenereerd.
2 NaOH + 2 Al + 2 H 2 O → 2 NaAlO 2 + 2 H 2
- Wanneer natriumhydroxide interageert met zinkmetaal, produceert het waterstofgas en natriumzinkaat.
2 NaOH + Zn → Na 2 ZnO 2 + H 2
- Reactie van niet-metaaloxiden met basis: Zout en water worden gevormd wanneer niet-metaaloxiden reageren met een base.
Niet-metaaloxide + Basis → Zout + Water
Wanneer calciumhydroxide een base laat reageren met koolstofdioxide, worden calciumcarbonaat en water geproduceerd.
Ca(OH) 2 + CO 2 → CaCO 3 + H 2 O
- Reactie van alkaliën/base met ammoniumzouten: Ammoniak ontstaat wanneer alkaliën reageren met ammoniumzouten.
Alkali + ammoniumzout → Zout + water + ammoniak
Wanneer calciumhydroxide reageert met ammoniumchloride, worden calciumchloridewater en ammoniak geproduceerd.
Ca(OH) 2 + NH 4 Cl → CaCl 2 + H 2 O + NH 3
Voorbeelden van basen
Basen zijn over het algemeen metaaloxide, metaalhydroxide, metaalwaterstofcarbonaat, metaalcarbonaten enz. Laten we enkele voorbeelden van basen bekijken met hun toepassing in tabelvorm:
| Basissen | Toepassingen |
|---|---|
| Kaliumhydroxide KOH | Gebruikt in alkalische batterijen |
| Natriumhydroxide NaOH | Gebruikt bij de productie van zeep en wasmiddel |
| Magnesium hydroxide Mg(OH) 2 | Gebruikt als maagzuurremmers |
| Natriumbicarbonaat NaHCO 3 | Gebruikt als zuiveringszout |
| Natriumcarbonaat Al 2 CO 3 | Gebruikt als wassoda |
| Ammoniak NH 3 | Gebruikt bij de productie van schoonmaak- en farmaceutische producten Java-lijst van |
| Calcium hydroxide Ca(OH) 2 | Gebruikt bij witwassen |
Gebruik van basen
Er zijn verschillende gebruiksscenario's van Base, enkele hiervan zijn:
- Natriumhydroxide wordt gebruikt bij de vervaardiging van zeep en papier. Natriumhydroxide (NaOH) wordt ook gebruikt bij de productie van rayon.
- Bleekpoeder is gemaakt van Ca(OH)2, algemeen bekend als gebluste kalk of calciumhydroxide.
- Calciumhydroxide wordt gebruikt om droge mengsels te maken voor schilderen en decoreren.
- Magnesiumhydroxide, in de volksmond bekend als magnesiumoxidemelk, is een laxeermiddel dat op grote schaal wordt gebruikt. Het wordt ook gebruikt als maagzuurremmer, omdat het de overtollige zuurgraad in de menselijke maag vermindert.
- In laboratoria is ammoniumhydroxide een kritisch reagens.
- Gebluste kalk kan worden gebruikt om overtollige zuurgraad in de bodem te neutraliseren.
Lees verder
- Zuur, base en zout
- Sterkte van zuur
- Ionisatie van zuur en base
Veelgestelde vragen over basen in de scheikunde
1. Wat zijn basen?
- Basisverbindingen hebben een bittere smaak.
- De textuur van de meeste basen is zeepachtig.
- Wanneer het op lakmoespapier wordt getest, verandert het in de meeste gevallen rood lakmoespapier in blauw lakmoespapier.
- In oplossing geleiden de basisverbindingen ook elektriciteit.
- Wanneer basisverbindingen in water worden opgelost, komen OH-ionen vrij.
2. Wat zijn de functies van basen?
Thuis gebruiken we basen als schoonmaakmiddelen en maagzuurremmers. Zepen, loog (dat wordt gebruikt in ovenreinigers), magnesiamelk en Tums zijn allemaal voorbeelden van populaire zelfgemaakte basissen. Elk van hen heeft een pH groter dan zeven, kan vrije waterstof verbruiken en zuren neutraliseren.
3. Wat is het belangrijkste onderscheid tussen een zuur en een base?
Zuren en basen zijn twee soorten bijtende chemicaliën. Zure materialen hebben een pH-waarde tussen 0 en 7, terwijl basen een pH-waarde tussen 7 en 14 hebben. Zuren zijn ionische chemicaliën die in water afbreken om het waterstofion (H+) te creëren, terwijl base dissocieert om OH-ion te geven.
4. Wat zijn de fysieke eigenschappen van basen?
- Ze hebben een bittere smaak.
- Hun waterige oplossingen hebben een zeepachtige kwaliteit.
- Ze veranderen de kleur van lakmoespapier van rood in blauw.
- Hun waterige oplossingen zijn elektrisch geleidend.
- Door het vrijkomen van waterstofgas reageren basen met metalen om zout te genereren.
5. Wat zal er gebeuren als calciumhydroxide reageert met ammoniumchloride?
Wanneer calciumhydroxide reageert met ammoniumchloride, worden calciumchloridewater en ammoniak geproduceerd.
Ca(OH) 2 + NH 4 Cl → CaCl 2 + H 2 O + NH 3
6. Wat gebeurt er als natriumhydroxide reageert met zinkmetaal?
Wanneer natriumhydroxide interageert met zinkmetaal, produceert het waterstofgas en natriumzinkaat.
2 NaOH + Zn → Na 2 ZnO 2 + H 2
7. Wat is Lewis-base?
Lewis-base zijn de verbindingen die een elektronpaar doneren aan de elektron-deficiënte verbinding. Voorbeeld omvat NH3.
8. Waar zijn basissen van gemaakt?
Basen bestaan doorgaans uit OH–ion. Naast deze metaaloxiden zijn carbonaten en waterstofcarbonaten ook basen.
9. Wat zijn alkaliën?
De basen die oplosbaar zijn in water worden alkaliën genoemd. Een voorbeeld is natriumhydroxide NaOH.
10. Wat zijn sterke basis en zwakke basis?
De basen die volledig dissociëren om OH te geven–ionen die oplossen in water worden Sterke Basis genoemd. Voorbeelden hiervan zijn NaOH. Zwakke basen zijn basen die niet volledig dissociëren om OH vrij te maken–ion wordt een zwakke base genoemd. Voorbeelden van zwakke basen zijn ammoniumhydroxide.
