Het concept van hybridisatie wordt gedefinieerd als het proces waarbij twee atomaire orbitalen worden gecombineerd om een nieuw type gehybridiseerde orbitalen te creëren. Deze vermenging resulteert doorgaans in de vorming van hybride orbitalen met totaal verschillende energieën, vormen, enzovoort. Hybridisatie wordt voornamelijk uitgevoerd door atomaire orbitalen met hetzelfde energieniveau. Zowel volledig gevulde als halfgevulde orbitalen kunnen echter aan dit proces deelnemen als hun energieën gelijk zijn. Het concept van hybridisatie is een uitbreiding van de valentiebindingstheorie die ons helpt de vorming van bindingen, bindingsenergieën en bindingslengtes te begrijpen.
Java-programmalus
Wat is hybridisatie?
Wanneer twee atomaire orbitalen samenkomen om een hybride orbitaal in een molecuul te vormen, wordt de energie van de orbitalen van individuele atomen herverdeeld om orbitalen met gelijkwaardige energie te verkrijgen. Dit staat bekend als hybridisatie.
De atomaire orbitalen met vergelijkbare energieën worden met elkaar vermengd tijdens het hybridisatieproces, dat meestal het samenvoegen van twee orbitalen of twee 'p'-orbitalen omvat, of het mengen van een 's'-orbitaal met een 'p'-orbitaal en een 's'-orbitaal. orbitaal met een 'd'-orbitaal.
Hybride orbitalen zijn de nieuwe orbitalen die als resultaat van dit proces worden gevormd. Wat nog belangrijker is, is dat hybride orbitalen kunnen worden gebruikt om atomaire bindingseigenschappen en moleculaire geometrie te verklaren. Koolstof vormt bijvoorbeeld vier enkele bindingen waarin de orbitaal van de valentieschil combineert met drie p-orbitalen van de valentieschil. Deze combinatie genereert vier gelijkwaardige sp3mengsels. Deze zullen in een tetraëdrisch patroon rond de koolstof worden gerangschikt, die aan vier verschillende atomen is gebonden.
Stappen om het type hybridisatie te bepalen
Om het type hybridisatie in een atoom of een ion te begrijpen, moeten de volgende regels worden gevolgd.
- Bepaal eerst het totale aantal valentie-elektronen in een atoom of ion.
- Tel vervolgens het aantal alleenstaande paren dat aan dat atoom of ion is gehecht.
- Nu kan het aantal benodigde orbitalen worden berekend door het aantal duplexen of octetten en het aantal vrije elektronenparen bij elkaar op te tellen.
- Opgemerkt moet worden dat de geometrie van orbitalen in atomen of ionen anders is als er geen eenzaam elektronenpaar is.
Kenmerken van hybridisatie
- Hybridisatie vindt plaats tussen atomaire orbitalen met gelijke energieën.
- Het aantal gevormde hybride orbitalen is gelijk aan het aantal atomaire orbitalen dat zich vermengt.
- Het is niet vereist dat alle halfgevulde orbitalen deelnemen aan hybridisatie. Zelfs orbitalen die volledig gevuld zijn maar een enigszins variërende energie hebben, kunnen meedoen.
- Hybridisatie vindt alleen plaats tijdens de vorming van bindingen, niet in een enkel gasvormig atoom.
- Als de hybridisatie van het molecuul bekend is, kan de vorm van het molecuul worden voorspeld.
- De grotere lob van de hybride orbitaal is altijd positief, terwijl de kleinere lob aan de andere kant altijd negatief is.
Soorten van hybridisatie
Hybridisatie kan worden geclassificeerd als sp3, sp2, sp, sp3d, sp3D2, of sp3D3gebaseerd op de soorten orbitalen die betrokken zijn bij het mengen.
sp Hybridisatie
Het komt voor wanneer één s- en één p-orbitaal in de hoofdschil van een atoom samenkomen om twee nieuwe equivalente orbitalen te vormen. De nieuw gevormde orbitalen staan bekend als sp-gehybridiseerde orbitalen. Het produceert lineaire moleculen onder een hoek van 180°. Het houdt in dat iemands orbitaal en één ‘p’-orbitaal met gelijke energie worden gecombineerd om een nieuwe hybride orbitaal te produceren die bekend staat als een sp-gehybridiseerde orbitaal.
- Het wordt ook wel diagonale hybridisatie genoemd.
- Elke sp-gehybridiseerde orbitaal bevat hetzelfde aantal s- en p-tekens.
- Alle berylliumverbindingen, zoals BeF2, Goed2en BeCl2, zijn voorbeelden.

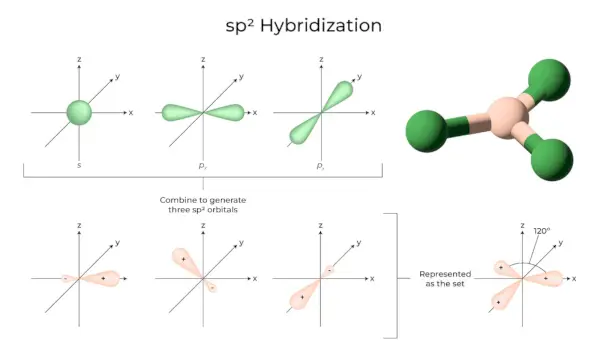
sp2Hybridisatie
Het komt voor wanneer één s- en twee p-orbitalen van de schil van hetzelfde atoom samenkomen om drie gelijkwaardige orbitalen te vormen. De nieuw gevormde orbitalen staan bekend als sp2hybride orbitalen. Het wordt ook wel trigonale hybridisatie genoemd. Het houdt in dat iemands orbitaal wordt gecombineerd met twee 'p'-orbitalen met gelijke energie om een nieuwe hybride orbitaal te creëren die bekend staat als sp2. Een trigonaal symmetriemengsel van s- en p-orbitalen wordt op 120 graden gehouden. Alle drie de hybride orbitalen blijven in hetzelfde vlak en vormen een hoek van 120° met elkaar.
- Elke gevormde hybride orbitaal heeft een ‘p’-karakter van 33,33% en 66,66%.
- De moleculen met een driehoekige vlakke vorm hebben een centraal atoom dat is gekoppeld aan drie andere atomen en is sp2gehybridiseerd. Boriumverbindingen zijn voorbeelden.
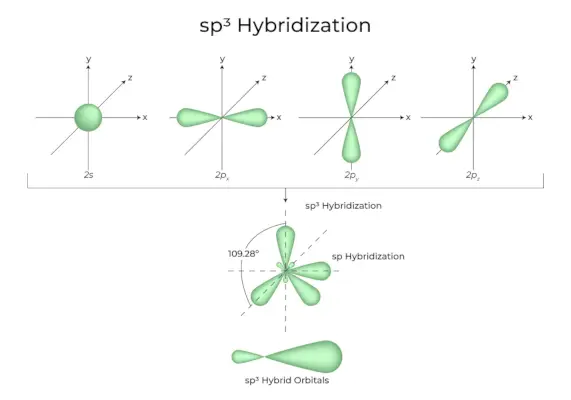
sp3Hybridisatie
Wanneer één ‘s’-orbitaal en drie ‘p’-orbitalen van dezelfde schil van een atoom worden gecombineerd om vier nieuwe gelijkwaardige orbitalen te vormen, staat de hybridisatie bekend als tetraëdrische hybridisatie of sp.3. De nieuw gevormde orbitalen staan bekend als sp3hybride orbitalen. Deze zijn gericht op de vier hoeken van een regelmatige tetraëder en vormen een hoek van 109°28′ met elkaar.
- De SP3hybride orbitalen vormen een hoek van 109,28 graden.
- Elke hybride orbitaal heeft een 25% s-karakter en een 75% p-karakter.
- Ethaan en methaan zijn twee voorbeelden.
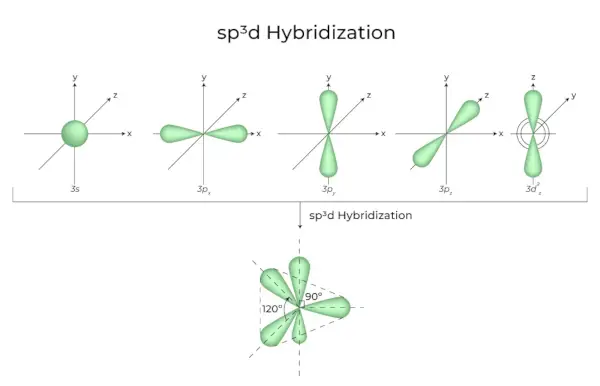
sp3d Hybridisatie
Het mengen van 1s-orbitalen, 3p-orbitalen en 1d-orbitalen resulteert in 5 sp3d-gehybridiseerde orbitalen met gelijke energie. Hun geometrie is trigonaal bipiramidaal. De combinatie van s-, p- en d-orbitalen resulteert in trigonale bipiramidale symmetrie. De equatoriale orbitalen zijn drie hybride orbitalen die in een hoek van 120° ten opzichte van elkaar zijn georiënteerd en in het horizontale vlak liggen.
- De overige twee orbitalen, bekend als axiale orbitalen, bevinden zich in het verticale vlak op 90 graden vlak van de equatoriale orbitalen.
- Hybridisatie in bijvoorbeeld fosforpentachloride (PCl5).
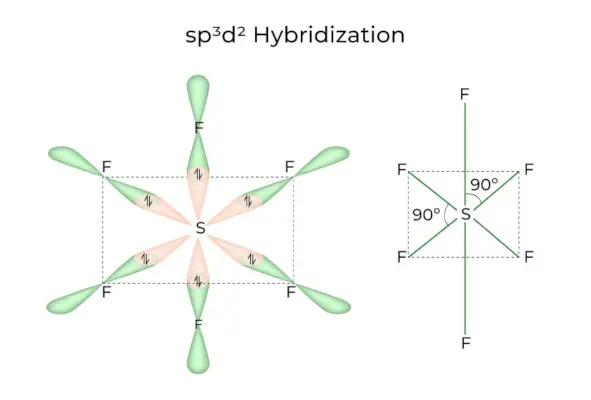
sp3D2 Hybridisatie
Wanneer 1s-, 3p- en 2d-orbitalen worden gecombineerd om 6 identieke sp3D2hybride orbitalen, de hybridisatie wordt sp genoemd3D2Hybridisatie. Deze zeven orbitalen wijzen naar de hoeken van een octaëder. Ze staan in een hoek van 90 graden ten opzichte van elkaar.
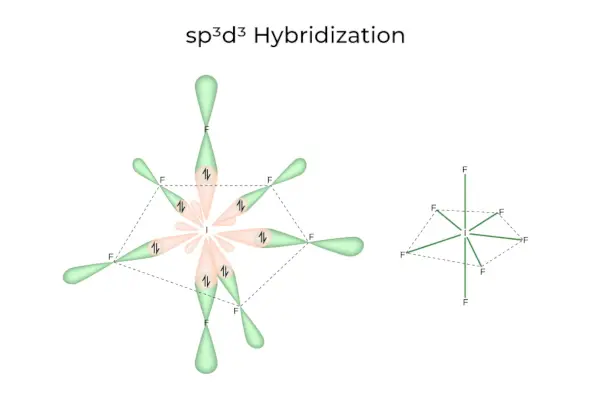
sp3D3Hybridisatie
Het heeft 1s-, 3p- en 3d-orbitalen, die samen 7 identieke sp vormen3D3hybride orbitalen. Deze zeven orbitalen wijzen naar de hoeken van een vijfhoekige bipiramidale. bijv. ALS6.
Vormen van hybridisatie
- Lineair: De sp-hybridisatie wordt veroorzaakt door de interactie van twee-elektronengroepen; de orbitale hoek is 180°. Trigonaal vlak: er zijn drie elektronengroepen bij betrokken, wat resulteert in sp2hybridisatie; de orbitalen liggen 120 ° uit elkaar. Tetraëdrische: Er zijn vier elektronengroepen bij betrokken, resulterend in sp3hybridisatie; de orbitale hoek is 109,5°. Trigonaal bipiramidaal: er zijn vijf elektronengroepen bij betrokken, resulterend in sp3d hybridisatie; de orbitale hoeken zijn 90° en 120°. Octaëdrische: Er zijn zes elektronengroepen bij betrokken, resulterend in sp3D2hybridisatie; de orbitalen liggen 90 ° uit elkaar.
Veelgestelde vragen over Hybridisatie
Vraag 1: Welke hybride orbitaal is van sp, sp2 en sp3 het meest elektronegatief?
Antwoord:
Het percentage van s-teken in sp, sp2, en sp3gehybridiseerde koolstof is respectievelijk 50%, 33,33% en 25%. Vanwege de bolvorm van de s-orbitaal wordt deze vanuit alle richtingen gelijkmatig door de kern aangetrokken. Als gevolg hiervan zal een hybride orbitaal met s-karakter dichter bij de kern liggen en dus elektronegatiever zijn. Als gevolg hiervan is de sp-gehybridiseerde koolstof het meest elektronegatief.
Vraag 2: Wat zijn hybride orbitalen?
Antwoord:
Hybride orbitalen worden gevormd door standaard atomaire orbitalen te combineren en resulteren in de vorming van nieuwe atomaire orbitalen.
Vraag 3: Wat zijn de vijf vormen van hybridisatie?
Antwoord:
Lineair, trigonaal vlak, tetraëdrisch, trigonaal bipiramidaal en octaëdrisch zijn de vijf basisvormen van hybridisatie.
Vraag 4: Waarom lijkt het amidemolecuul op sp3gehybridiseerd maar is sp2?
Antwoord:
Als het atoom wordt omsloten door twee of meer p-orbitalen of als het een eenzaam paar heeft dat in een p-orbitaal kan springen, zal het algemene hybridisatieproces veranderen. Als gevolg hiervan komt, in het geval van een amidemolecuul, het eenzame paar een p-orbitaal binnen, wat resulteert in drie aangrenzende parallelle p-orbitalen.
Vraag 5: Wat is de regel van Bent?
jpa in het voorjaar
Antwoord:
Een centraal atoom dat met meerdere groepen in een molecuul is verbonden, zal hybridiseren, waardoor orbitalen met meer s-karakter naar elektropositieve groepen worden gericht en orbitalen met meer p-karakter naar elektronegatieve groepen worden gericht.
